Arbeitsblatt: Test Atombau und PS inkl. Lösungen
Material-Details
Test für 9. Klasse inkl. Lösungen
Im Word-Format, daher einfach änderbar!
Chemie
Atome
9. Schuljahr
3 Seiten
Statistik
100662
4144
53
02.07.2012
Autor/in
Basel (Spitzname)
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
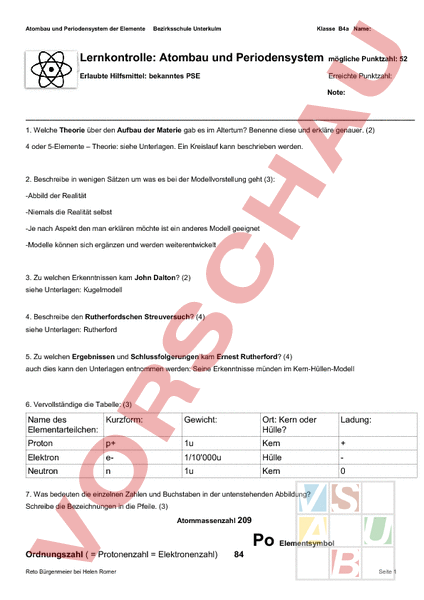
Atombau und Periodensystem der Elemente Bezirksschule Unterkulm Klasse B4a Name: Lernkontrolle: Atombau und Periodensystem mögliche Punktzahl: 52 Erlaubte Hilfsmittel: bekanntes PSE Erreichte Punktzahl: Note: 1. Welche Theorie über den Aufbau der Materie gab es im Altertum? Benenne diese und erkläre genauer. (2) 4 oder 5-Elemente – Theorie: siehe Unterlagen. Ein Kreislauf kann beschrieben werden. 2. Beschreibe in wenigen Sätzen um was es bei der Modellvorstellung geht (3): -Abbild der Realität -Niemals die Realität selbst -Je nach Aspekt den man erklären möchte ist ein anderes Modell geeignet -Modelle können sich ergänzen und werden weiterentwickelt 3. Zu welchen Erkenntnissen kam John Dalton? (2) siehe Unterlagen: Kugelmodell 4. Beschreibe den Rutherfordschen Streuversuch? (4) siehe Unterlagen: Rutherford 5. Zu welchen Ergebnissen und Schlussfolgerungen kam Ernest Rutherford? (4) auch dies kann den Unterlagen entnommen werden: Seine Erkenntnisse münden im Kern-Hüllen-Modell 6. Vervollständige die Tabelle: (3) Name des Kurzform: Elementarteilchen: Gewicht: Ort: Kern oder Hülle? Ladung: Proton p 1u Kern Elektron e- 1/10�00u Hülle Neutron 1u Kern 0 7. Was bedeuten die einzelnen Zahlen und Buchstaben in der untenstehenden Abbildung? Schreibe die Bezeichnungen in die Pfeile. (3) Atommassenzahl 209 Po Elementsymbol Ordnungszahl Protonenzahl Elektronenzahl) Reto Bürgenmeier bei Helen Romer 84 Seite 1 Atombau und Periodensystem der Elemente Bezirksschule Unterkulm Klasse B4a Name: 8. Wie berechnen wir die Anzahl Neutronen im Kern? (1) Neutronenzahl Atommassenzahl Ordnungszahl 9. Welche Elementarteilchen sind entscheidend für die Eigenschaften eines Elementes: (1) Elektronen 10. Was spiegeln folgende Angaben im PSE wieder? Ergänze die folgenden Gleichungen: (2) siehe auch Zusammenfassungen: Atombau und PSE, Das PSE Periodennummer Anzahl Schalen Gruppennummer Gleiche Elektronenzahl der Valenzelektronen (Elektronen der äussersten Schale) ähnliche Eigenschaften 11. Was sind Isotope? Erkläre anhand eines Beispiels: (2) gibt es in unterschiedlichen Varianten von der Neutronenzahl her. Daher rührt dann auch die „krumme Atommassenzahl. Diese ist ein Zeichen dafür das es Isotope gibt. Siehe auch den Filmauschnitt dazu. 12. Nenne 3 gemeinsame Eigenschaften der Alkalimetalle. (3) -reagieren gerne mit Wasser -verformbar (mit Messer zu schneiden) -glänzende Schnittfläche -Metalle 13. Nenne eine Elementfamilie die sehr ähnliche Eigenschaften wie die Alkalimetalle aufweisen: (1) Erdalkalimetalle 14. Was bestimmt das chemische Verhalten der Elemente? (2) Die Aussenelektronen. 15. Nenne eine je eine Elementfamilie mit Gasen: die gerne und die gar nicht gerne reagieren: (2) Halogen und Edelgase 16. Ergänze die fehlenden Angaben. Verwende dabei das Periodensystem der Elemente. (3) Element Protonenzahl Ordnungszahl Wasserstoff 1 1 Elementsymbol Nummer der Hauptgruppe Anzahl der Schalen Anzahl der Aussenelektronen Sauerstoff 2 Au Reto Bürgenmeier bei Helen Romer Seite 2 Atombau und Periodensystem der Elemente Bezirksschule Unterkulm Klasse B4a Name: 94 17. Wie heisst der Begründer des Kern-Hüllen-Modells? (1) E. Rutherford 18. Wie heisst der Begründer des Schalenmodells? (1) Niels Bohr 19. Zeichne die Schalenmodelle von: (4) Si Man kann aus dem PSE ablesen: Elektronen L: 8 Elektronen M:18 3. Periode: d.h. drei Schalen, wir wissen möglich sind in den Schalen: K: 2 Elektronen wir können weiter aus dem PSE ablesen äussersten Schale (M-Schale, wo 18 möglich wären) sind es 4 Elektronen 4. Hauptgruppe d.h. in der --- d.h. wir können das Schalenmodell Zeichnen Wir lesen aus dem PSE ab: 4. Periode: Es kommt noch N-Schale dazu von den 32 möglichen Elektronen, ist ein Elektron in dieser Schale „unterwegs dies können wir aus dem PSE ablesen, weil das Element in der 1.Gruppe steht. Anmerkung: Mit der Formel 2n2 können wir die Anzahl Elektronen von der Schalennummer ableiten. z.B. 4. Schale d.h. n4 2*4*432 Elektronen in der 4. oder N-Schale kein Testinhalt – aber hilfreich! 20. Zeichne Na im Kimball-Modell auf die Rückseite und ergänze mit der LEWIS-Formel. (2) siehe Unterlagen und Dropbox 21. Warum kam es erst spät zu einer Ordnung im PSE? (1) Am Anfang waren nur wenige Elemente bekannt. Man ordnete sie nach Gewicht. Erst später begann man immer mehr ähnliche Eigenschaften zwischen den Elementen und natürlich auch immer mehr Elemente zu entdecken und das Bedürfnis nach eine besseren Ordnung wuchs. 22. Wie ist die Ordnung des PSE aufgebaut? Nenne zwei Punkte: Nach Atommassen Ordnungszahl und nach ähnlichen Eigenschaften. 23. Nenne 3 Strahlungstypen, welche von einem radioaktiven Stoff ausgehen? Gib jeweils auch ihre Ladung an: (3) Alpha Beta -Strahlung Gamma keine Ladung VIEL GLÜCK! Reto Bürgenmeier bei Helen Romer Seite 3