Arbeitsblatt: Atombau / Periodensystem
Material-Details
BC Test Atombau / Periodensystem
Chemie
Atome
9. Schuljahr
2 Seiten
Statistik
117070
3641
78
29.05.2013
Autor/in
Lu1996 (Spitzname)
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
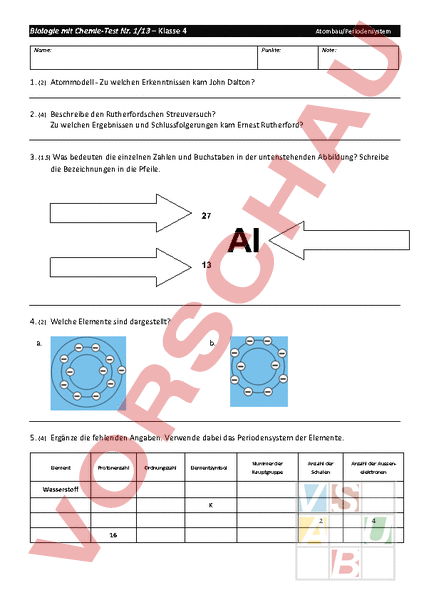
Biologie mit Chemie-‐Test Nr. 1/13 – Klasse 4 Atombau/Periodensystem Name: Punkte: Note: 1. (2) Atommodell -‐ Zu welchen Erkenntnissen kam John Dalton? 2. (4) Beschreibe den Rutherfordschen Streuversuch? Zu welchen Ergebnissen und Schlussfolgerungen kam Ernest Rutherford? 3. (1.5) Was bedeuten die einzelnen Zahlen und Buchstaben in der untenstehenden Abbildung? Schreibe die Bezeichnungen in die Pfeile. 27 Al 13 4. (2) Welche Elemente sind dargestellt? a. b. 5. (4) Ergänze die fehlenden Angaben. Verwende dabei das Periodensystem der Elemente. Nummer der Anzahl der Anzahl der Aussen-‐ Hauptgruppe Schalen elektronen K 2 4 16 Element Protonenzahl Ordnungszahl Wasserstoff Elementsymbol Biologie mit Chemie-‐Test Nr. 1/13 – Klasse 4 Name: Atombau/Periodensystem Punkte: Note: 6. (2) Zeichne die Schalenmodelle von: Kohlenstoff und Natrium 7. (2) Was versteht man unter dem Begriff Valenzelektronen? Wieso ist diese für den Chemiker besonders wichtig? 8. (2) Was hat der Bau der Atome mit der Anordnung der Elemente im Periodensystem zu tun? 9. (3) Notiere die Formeln folgender Verbindungen: a. Eisen(II)sulfid c. Kupfer(II)chlorid e. Aluminium(III)sulfid b. Stickstoff(II)oxid d. Blei(IV)chlorid f. Phosphor(V)oxid Wertigkeit: Chlor: I , Schwefel und Sauerstoff : II 10. (3) Erläutere am Beispiel der Reaktion von Kupfer die Merkmale einer Oxidation! Stelle die Reaktionsgleichung auf! 11. (2) Schwefel reagiert bei der Verbrennung mit Sauerstoff. a. Was lässt sich bei der Reaktion beobachten? b. Wie reagieren Metalle mit dem Sauerstoff in der Luft? 12. (2) Zeichne das Strukturmodell und das Kugelstäbchenmodell folgender Stoffe. a. CH4 b. C3H8 c. C2H6O d. C2H5OH