Arbeitsblatt: Test Atombau und PSE
Material-Details
Ein Test zum Atombau und Periodensystem
Chemie
Atome
9. Schuljahr
4 Seiten
Statistik
14065
3403
88
12.01.2008
Autor/in
iMike (Spitzname)
Bubenbergstrasse 15
3700 Spiez
3700 Spiez
079 356 09 18
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
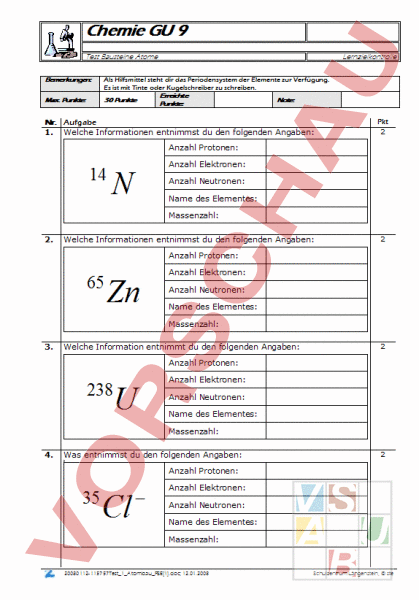
Chemie GU 9 Test Bausteine Atome Lernzielkontrolle Bemerkungen: Als Hilfsmittel steht dir das Periodensystem der Elemente zur Verfügung. Es ist mit Tinte oder Kugelschreiber zu schreiben. Max. Punkte: 30 Punkte Erreichte Punkte: Note: Pkt 2 Nr. Aufgabe 1. Welche Informationen entnimmst du den folgenden Angaben: 14 Anzahl Protonen: 7 Anzahl Elektronen: 7 Anzahl Neutronen: 7 Name des Elementes: Stickstoff Massenzahl: 2. Zn Anzahl Protonen: 30 Anzahl Elektronen: 30 Anzahl Neutronen: 35 Name des Elementes: Massenzahl: Zink 65 2 Welche Information entnimmt du den folgenden Angaben: 238 4. 2 Welche Informationen entnimmst du den folgenden Angaben: 65 3. 14 Anzahl Protonen: 92 Anzahl Elektronen: 92 Anzahl Neutronen: 146 Name des Elementes: Uran Massenzahl: 238 2 Was entnimmst du den folgenden Angaben: 35 Cl Anzahl Protonen: 17 Anzahl Elektronen: 18 Anzahl Neutronen: 18 Name des Elementes: Massenzahl: 20080112-115757Test_1_Atombau_PSE[1].doc; 12.01.2008 Chlor 35 Schulzentrum Längenstein, ste Chemie GU 9 Test Bausteine Atome 5. Lernzielkontrolle 2 Definiere den Begriff „Isotop und gib ein Beispiel an: Als Isotop werden Elemente mit der gleichen Ordnungszahl aber mit unterschiedlicher Massenzahl bezeichnet. Beispiel: 3H und 2H sind Isotope des Wasserstoffs. 6. 2 Definiere den Begriff „Ionen und gib ein Beispiel an: Ionen sind geladene Atome. Normalerweise ist die Anzahl der Elektronen gleich der Anzahl Protonen. Sind aber mehr oder auch weniger Elektronen vorhanden, so ist das Atom geladen. Fehlt dem Wasserstoffatom sein Elektron, so ist es positiv geladen. Wir bezeichnen es als H 7. Lies die folgenden Informationen zum Periodensystem der Elemente heraus: Name: Platin Symbol: Pt Ordnungszahl: 78 Anzahl Elektronen: 78 Anzahl Neutronen: 117 Massenzahl: 195 Schmelzpunkt: 1769C Siedepunkt: 3830C Dichte: 21.4 g/cm3 Elektronnegativität: 2.2 20080112-115757Test_1_Atombau_PSE[1].doc; 12.01.2008 Element „Platin aus dem 3 Schulzentrum Längenstein, ste Chemie GU 9 Test Bausteine Atome 8. Lernzielkontrolle 1 Warum nennt man die Ordnungszahl auch Kernladungszahl? Weil die Kernladungszahl die Zahl der Protonen wiedergibt. Die Anzahl Protonen ist zugleich die Ordnungszahl des Atoms. 9. 1 Wie gross ist die kleinste Elementarladung? Kreuze an 1.602 10 18 1.602 10 19 1.602 10 24 10. Wie ändert sich die elektrostatische Anziehungskraft zwischen einem 1 Proton und einem Elektron, wenn der Abstand zwischen ihnen verdreifacht wird? 1 3 1 6 1 9 3 11. Kreuze alle richtigen Aussagen an: Die Kernladungszahl entspricht auch der Anzahl Neutronen. Die Masse der Atomhülle ist ca. 100 mal kleiner als die des Atoms. Der Atomkern beinhaltet ca. 99.9% der ganzen Masse des Atoms. Der Durchmesser eines Atoms beträgt ca. 10-10 Der Atomkern ist ca 10 mal kleiner, als die Atomhülle. Im Atomkern sind gleich viele Protonen wie Elektronen. 12. Definiere den Begriff „1 Mol und setze ihn in Beziehung zur Massenzahl 2 des Atoms. 1 Mol sind 6.02 1023 Teilchen. 1 Mol Atome entsprechen der angegebenen Massenzahl in g. 13. Bei radioaktiver Strahlung handelt es sich unter anderem um zweifach 2 positive Teilchen mit der Masse 4u. Um welche Atomkerne handelt es sich? Heliumkerne mit 2 Protonen und 2 Neutronen 20080112-115757Test_1_Atombau_PSE[1].doc; 12.01.2008 Schulzentrum Längenstein, ste Chemie GU 9 Test Bausteine Atome Lernzielkontrolle 14. Worin unterscheidet sich ein Wasserstoff-Atom von einem Deuterium- 1 Atom? Deuterium Deuterium Deuterium Deuterium hat hat hat hat 2 2 1 1 Protonen mehr als das Wasserstoffatom Neutronen mehr als das Wasserstoffatom Proton mehr als das Wasserstoffatom Neutron mehr als das Wasserstoffatom Ag 2 16. Zwei positiv geladene Teilchen stossen sich grundsätzlich voneinander ab. Wie ist es dennoch möglich, dass zwei (oder mehr) positiv geladene Protonen im Atomkern „aneinanderkleben? 2 15. Silber ist ein Mischelement und besteht aus den Isotopen 107 Ag und 109 Berechne die prozentualen Anteile der beiden Isotope. mittlere Atommasse Atommasse von 107 Ag Atommasse von 109 Ag 107.87 106.9 108.9 Anteil 51.5 48.5 Die zusätzlich existierende Kernkraft muss um ein vielfaches grösser sein, als die abstossende elektrostatische Kraft. 20080112-115757Test_1_Atombau_PSE[1].doc; 12.01.2008 Schulzentrum Längenstein, ste