Arbeitsblatt: Atom
Material-Details
Dossier
Biologie
Gemischte Themen
9. Schuljahr
13 Seiten
Statistik
156860
807
17
30.01.2016
Autor/in
Iris Claude
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
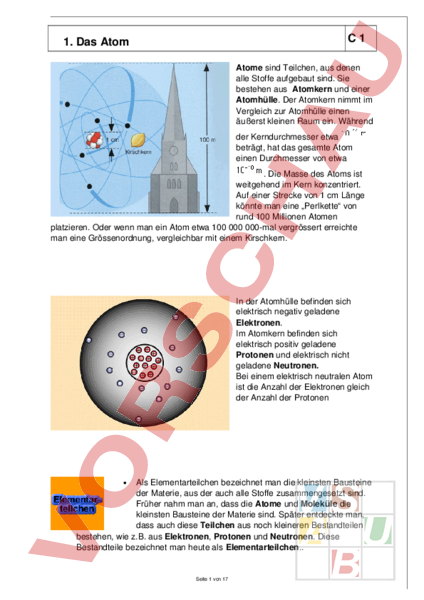
C1 1. Das Atom Atome sind Teilchen, aus denen alle Stoffe aufgebaut sind. Sie bestehen aus Atomkern und einer Atomhülle. Der Atomkern nimmt im Vergleich zur Atomhülle einen äußerst kleinen Raum ein. Während der Kerndurchmesser etwa beträgt, hat das gesamte Atom einen Durchmesser von etwa Die Masse des Atoms ist weitgehend im Kern konzentriert. Auf einer Strecke von 1 cm Länge könnte man eine „Perlkette von rund 100 Millionen Atomen platzieren. Oder wenn man ein Atom etwa 100 000 000mal vergrössert erreichte man eine Grössenordnung, vergleichbar mit einem Kirschkern. In der Atomhülle befinden sich elektrisch negativ geladene Elektronen. Im Atomkern befinden sich elektrisch positiv geladene Protonen und elektrisch nicht geladene Neutronen. Bei einem elektrisch neutralen Atom ist die Anzahl der Elektronen gleich der Anzahl der Protonen Als Elementarteilchen bezeichnet man die kleinsten Bausteine der Materie, aus der auch alle Stoffe zusammengesetzt sind. Früher nahm man an, dass die Atome und Moleküle die kleinsten Bausteine der Materie sind. Später entdeckte man, dass auch diese Teilchen aus noch kleineren Bestandteilen bestehen, wie z.B. aus Elektronen, Protonen und Neutronen. Diese Bestandteile bezeichnet man heute als Elementarteilchen Seite 1 von 17 C2 1. Das Atom Der Atomkern Der Atomkern befindet sich im Innern des Atoms und ist elektrisch positiv geladen. Er enthält Protonen und Neutronen. Protonen Protonen sind elektrisch positiv geladene Elementarteilchen. Neutronen Neutronen sind nicht geladene, neutrale Elementarteilchen. Die Atomhülle Die Atomhülle ist der äussere Bereich um den Kern herum. Sie ist elektrisch negativ geladen und enthält die Elektronen. Elektronen Elektronen sind elektrisch negativ geladene Elementarteilchen. Ihre Masse beträgt nur / 1836 der Masse eines Protons. Seite 2 von 17 C3 1. Das Atom Man weiß mittlerweile, dass einige dieser Elementarteilchen aus noch kleineren Teilchen, den sogenannten Quarks, bestehen. Licht wird von Lichtquellen in Form von Lichtquanten abgegeben. Diese Lichtquanten kann man ebenfalls als Teilchen betrachten. Sie werden auch als Photonen bezeichnet. Das Atom und seine Elementarteilchen Bereich Teilchen Eigenschaften Atomkern elektrisch positiv geladen Protonen: p Neutronen: Elektronen: e Atomhülle elektrisch negativ geladen elektrisch positiv geladen relative Masse 1 elektrisch neutral (keine Ladung) relative Masse 1 elektrisch negativ geladen relative Masse 0,00054 Positive Ladungen negative Ladungen Gesamtladung 0 Protonenanzahl Elektronenanzahl Ordnungszahl Massenzahl Anzahl der Protonen Anzahl der Neutronen Seite 3 von 17 C4 2. Ionen Ionen sind elektrisch geladene Teilchen. Positiv geladene Ionen heissen Kationen, negativ geladene werden Anionen genannt. Ionen sind elektrisch geladene Teilchen, aus denen Stoffe aufgebaut sind. Sie entstehen dadurch, dass aus der Atomhülle eines zuvor neutralen Atoms Elektronen abgegeben oder aufgenommen werden. Wird ein Elektron aufgenommen, so entsteht ein negativ geladenes Ion. Solche Ionen heißen Anionen. Wird ein Elektron abgegeben, so entsteht ein positv geladenes Ion. Solche Ionen heißen Kationen. Ionen entstehen beispielsweise bei der Lösung von Salzen, Basen oder Säuren in Wasser. Dieser Vorgang wird als Dissoziation bezeichnet. So dissoziert z.B. Kochsalz (NaCl) bei Lösung in Wassser in positive NatriumIonen und negativ ChloridIonen: NatriumIonen sind Kationen, ChloridIonen dagegen Anionen. Seite 4 von 17 C5 2. Ionen Seite 5 von 17 C6 3. Moleküle Teilchen, die aus mindestens zwei Atomen bestehen, werden Moleküle genannt. Ein Molekül Sauerstoff besteht aus zwei miteinander verbundenen Sauerstoffatomen. Diese werden durch starke Kräfte zusammen gehalten. Ein Molekül Stickstoff besteht aus zwei miteinander verbundenen Stickstoffatomen. Auch zwischen ihnen wirken starke Kräfte Bei den Stoffen Sauerstoff und Stickstoff handelt es sich nicht um chemische Verbindungen, denn die Moleküle von Sauerstoff und Stickstoff sind, nur aus einer Atomsorte zusammengesetzt. Chemische Verbindungen sind Reinstoffe, deren Teilchen aus mehr als einer Atomsorte bestehen. Demnach handelt es sich beispielsweise bei Wasser nicht um ein Element, wie im Altertum angenommen wurde, sondern um eine chemische Verbindung. Der Stoff kann durch eine chemische Reaktion zerlegt werden. Diese Verbindung besteht aus den Elementen Sauerstoff und Wasserstoff. Auch Teilchen, die aus mehreren Atomarten bestehen, nennt man Moleküle. Wasser ist eine chemische Verbindung, in deren Molekülen je ein Sauerstoffatom mit je zwei Wasserstoffatomen verbunden ist. Kalottenmodell und Formel des Wassermoleküls Seite 6 von 17 C7 3. Moleküle Seite 7 von 17 4. Teilchenmodell und Aggregatzustände Seite 8 von 17 C8 5. Chemische Bindungen C9 1. Die Ionenbindung Die Ionenbindung ist eine Art der chemischen Bindung, die durch elektrostatische Anziehungskräfte zwischen elektrisch entgegengesetzt geladenen Ionen hervorgerufen wird. Zustandekommen der Ionenbindung Entgegengesetzt elektrisch geladene Ionen ziehen sich an. Gleichartig geladene Ionen stoßen sich ab. Da die elektrischen Kräfte nach allen Seiten des Raumes wirken, umgibt sich ein positives Ion mit mehreren negativen, ein negativ geladenes mit mehreren positiven. Es bilden sich regelmäßig geformte Körper, die Ionenkristalle. Die zwischen den elektrisch entgegengesetzt geladenen Ionen in einem Ionenkristall wirkenden Anziehungskräfte stellen eine chemische Bindung dar. Sie wird als Ionenbindung (oder Ionenbeziehung) bezeichnet. Die Ionenbindung wird durch Anziehungskräfte zwischen elektrisch positiven und elektrisch negativen Ionen bewirkt. Bei der chemischen Reaktion gibt das Natriumatom das Außenelektron an das Chloratom ab. Da die Protonenzahl im Kern unverändert bleibt, wird aus dem elektrisch neutralen Natriumatom das einfach positiv geladene NatriumIon und aus dem elektrisch neutralen Chloratom das einfach negativ geladene ChloridIon. C/UMT_BI_9_156860_Atom.doc IS/30.01.16 10 6. Chemische Bindungen 2. Die Atombindung Die Atombindung ist eine der drei chemischen Hauptbindungsarten, zu denen man auch die Ionenbindung und die Metallbindung zählt. Die Atombindung tritt bei Molekülen auf. Die Atombindung beruht auf gemeinsam genutzten Elektronenpaaren 3. Die Metallbindung Die Metallbindung ist eine Art der chemischen Bindung, die durch Anziehungskräfte zwischen MetallIonen und freien Elektronen verursacht wird. Die meisten Metalle der Hauptgruppen besitzen nur wenige Außenelektronen, die leicht vom Metallatom abgegeben werden, da die Atomkerne auf die Außenelektronen nur geringfügige Anziehungskräfte ausüben. Dadurch entstehen positiv geladene MetallIonen und nahezu frei bewegliche Elektronen. C/UMT_BI_9_156860_Atom.doc IS/30.01.16 6. Chemische Bindungen 11 Diese frei beweglichen Elektronen ermöglichen daher die gute elektrische Leitfähigkeit und die hohe Wärmeleitfähigkeit der Metalle. C/UMT_BI_9_156860_Atom.doc IS/30.01.16 8. Periodensystem der Elemente 12 Für Stoffe, die durch chemische Verfahren nicht weiter zerlegbar und auch nicht ineinander überführbar sind, führte der französische Chemiker ANTOINE LAVOISIER den Begriff chemisches Element ein. Er löste damit die Vierelementenlehre (Feuer, 332 v. Chr.) ab. Wasser, Luft, Erde) von ARISTOTELES (384 Heute bezeichnet man als chemisches Element einen reinen Stoff, der nur aus einer Atomsorte besteht. Die Elemente unterscheiden sich durch die Anzahl der Protonen in ihrem Atomkern. Ein chemisches Element ist ein Stoff, dessen Atome die gleiche Anzahl Protonen im Kern besitzen. Metalle gehören zu den Elementen. Beispielsweise besteht reines Aluminium nur aus Aluminiumatomen. Das Element Aluminium besteht aus einer Atomsorte, dessen Atome 13 Protonen im Kern enthalten. Der Chemiker JÖNS JACOB BERZELIUS (1797 1848) schlug ein System von Zeichen vor, das noch heute überall auf der Welt verwendet wird. Er bildete die Zeichen für ein Element aus den Buchstaben des griechischen oder lateinischen Namens dieses Elements und nannte diese Zeichen Symbole. Bedeutung eines Symbols: 1. Das Symbol ist ein Zeichen für den Stoff. 2. Es ist das chemische Zeichen für ein Element. 3. Es ist das Zeichen für ein Atom des Elements. Heute sind über 105 Elemente bekannt. Es existieren entsprechend viele Atomsorten. Daher ist es sehr wichtig, über ein Hilfsmittel zu verfügen, das Ordnung in die Vielfalt der Elemente und ihrer Atome bringt. Dieses Hilfsmittel ist das von LOTHAR MEYER (18301895) und DIMITRI MENDELEJEW (18341907) unabhängig voneinander entwickelte Periodensystem der Elemente (PSE). Das Periodensystem der Elemente (PSE) ist eine Anordnung der chemischen Elemente nach ihrem Atombau und ihren Eigenschaften. C/UMT_BI_9_156860_Atom.doc IS/30.01.16 13 7. Periodensystem der Elemente Ein chemisches Element ist ein Stoff, dessen Atome alle die gleiche Anzahl von Protonen im Kern enthalten. Elemente werden in der chemischen Zeichensprache mit Symbolen gekennzeichnet. Bezeichnungen und Symbole chemischer Elemente Deutsche Bezeichnung Lateinische griechische Elementsymbol Bezeichnung Wasserstoff Hydrogenium Schwefel Sulfur Gold Aurum Au Quecksilber Hydrargyrum Hg Die Ordnungszahl Die Ordnungszahl bestimmt die Reihenfolge der Elemente. Sie entspricht der Anzahl der Protonen im Atomkern eines Elementes (Kernladungszahl) und gibt zugleich die Anzahl der Elektronen in der Atomhülle an. Atommodell Aluminium hat die Ordnungszahl 13. Ein Atom des Elementes besitzt im Atomkern 13 Protonen und in der Atomhülle 13 Elekronen. Die Ordnungszahl von Aluminium ist 13. C/UMT_BI_9_156860_Atom.doc Die bei der Anordnung der Elemente im Periodensystem entstehenden IS/30.01.16 waagrechten Reihen nennt man Perioden 14 7. Periodensystem der Elemente Die Nummer der Periode entspricht der Anzahl der besetzten Elektronenschalen in der Atomhülle. Nummer der Periode Anzahl der besetzten Elektronenschalen (Energieniveaus) Nummer der äussersten (besetzten) Elektronenschale Das Schalenmodell der Atomhülle C/UMT_BI_9_156860_Atom.doc IS/30.01.16 15 7. Periodensystem der Elemente Gruppen Gruppen II III IV VI VII VIII Die bei der Anordnung der Elemente im Periodensystem entstehenden senkrechten Reihen nennt man Gruppen. Die Gruppennummer gibt jeweils die Anzahl der Aussenelektronen an. Die gleiche Anzahl von Aussenelektronen ist die Ursache für die chemische Verwandtschaft der Elemente innerhalb einer Gruppe („Elementfamilien) C/UMT_BI_9_156860_Atom.doc IS/30.01.16 7. Periodensystem der Elemente 16 Aus der Stellung der Elemente im Periodensystem lässt sich also der Aufbau der Elektronenhülle ihrer Atome ablesen. In der Atomhülle bewegen sich die Elektronen in bestimmten schalenförmigen Räumen um den Atomkern. Die Elektronen der äusseren Schale, die Aussenelektronen, bestimmen das chemische Verhalten der Elemente. Stellung des Elements im Periodensystem 1.1.1 Aussagen zum Atombau Ordnungszahl Anzahl der Protonen Anzahl der Elektronen Periode Anzahl der besetzten Energieniveaus (Elektronenschalen) Anzahl der Aussenelektronen Hauptgruppennummer C/UMT_BI_9_156860_Atom.doc IS/30.01.16 17 7. Periodensystem der Elemente 4. Stellung im PSE und Atombau Stickstoff Argon Ordnungszahl 7 7 Protonen, 7 Elektronen 2. Periode 2 besetzte Energienieveaus (Schalen) V. Hauptgruppe 5 Aussenelektronen Ordnungszahl 18 18 Protonen, 18 Elektronen 3. Periode 3 besetzte Energienieveaus (Schalen)VIII. Hauptgruppe 8 Aussenelektronen C/UMT_BI_9_156860_Atom.doc IS/30.01.16