Arbeitsblatt: PSE Test
Material-Details
Test zum PSE. Atomaufbau und Elektronenkonfiguration
Chemie
Elemente / Periodensystem
9. Schuljahr
4 Seiten
Statistik
15715
2261
62
13.02.2008
Autor/in
iMike (Spitzname)
Bubenbergstrasse 15
3700 Spiez
3700 Spiez
079 356 09 18
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
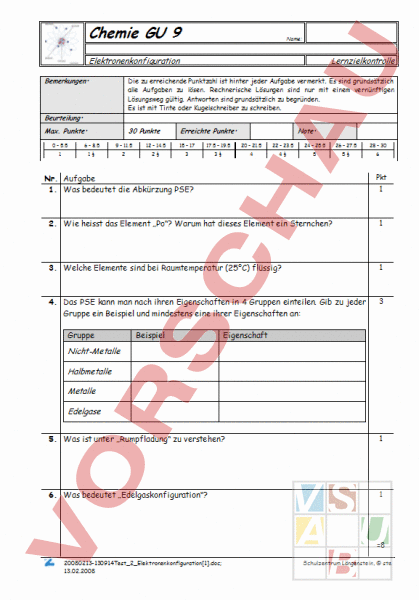
Chemie GU 9 Name: Elektronenkonfiguration Bemerkungen: Lernzielkontrolle Die zu erreichende Punktzahl ist hinter jeder Aufgabe vermerkt. Es sind grundsätzlich alle Aufgaben zu lösen. Rechnerische Lösungen sind nur mit einem vernünftigen Lösungsweg gültig. Antworten sind grundsätzlich zu begründen. Es ist mit Tinte oder Kugelschreiber zu schreiben. Beurteilung: Max. Punkte: 30 Punkte Erreichte Punkte: Note: 0 – 5.5 6 – 8.5 9 – 11.5 12 – 14.5 15 – 17 17.5 – 19.5 20 – 21.5 22 – 23.5 24 – 25.5 26 – 27.5 28 – 30 1 1 2 2 3 3 4 4 5 5 6 Pkt Nr. Aufgabe 1. Was bedeutet die Abkürzung PSE? 1 2. Wie heisst das Element „Po? Warum hat dieses Element ein Sternchen? 1 3. Welche Elemente sind bei Raumtemperatur (25C) flüssig? 1 4. Das PSE kann man nach ihren Eigenschaften in 4 Gruppen einteilen. Gib zu jeder Gruppe ein Beispiel und mindestens eine ihrer Eigenschaften an: 3 Gruppe Beispiel Eigenschaft Nicht-Metalle Halbmetalle Metalle Edelgase 5. Was ist unter „Rumpfladung zu verstehen? 1 6. Was bedeutet „Edelgaskonfiguration? 1 8 20080213-130914Test_2_Elektronenkonfiguration[1].doc; 13.02.2008 Schulzentrum Längenstein, ste Chemie GU 9 Lernzielkontrolle 7. Zeichne im Schalenmodell die Elektronenkonfiguration der folgenden Elemente: 24 12 35 17 Mg 56 26 138 56 Fe Cl Ba 2 2 2 8. Gib für die folgenden Elemente die Anzahl Valenzelektronen an: Te Ca 2 Xe Valenzelektronen 9. In einem bruchstückhaften Text erfährst du, dass ein Element ein Valenzelektron besitzt und bei 64C schmilzt. Was weisst du über dieses Element? 1 10. Wie werden die Elemente der VII. Hauptgruppe genannt? Warum haben sie ähnliche chemische Eigenschaften? 2 20080213-130914Test_2_Elektronenkonfiguration[1].doc; 13.02.2008 Schulzentrum Längenstein, ste Chemie GU 9 Lernzielkontrolle 17 2 11. Gib die Lewisformel für die folgenden Elemente an: Na Lewisformel 12. Erkläre, warum die Ionisierungsenergie beim Element Aluminium (Al) nach dem dritten Elektron sprunghaft ansteigt (von 28.4 auf 120 eV) 1 13. Welches Atom hat die grössere 1. Ionisierungsenergie: Caesium-Atom oder Lithium-Atom? Begründe deine Antwort. 2 14. Wodurch unterscheidet sich das Helium-Atom von den andern Edelgas-Atomen? 1 15. Wasserstoff ist ein Nicht-Metall, steht aber wie die Alkalimetalle in der ersten Hauptgruppe. Was spricht für diese Einteilung? 1 16. Dalton definierte ein Element als einen Stoff, der aus lauter gleichen Atomen besteht. Diese Definition lässt sich heute nicht mehr aufrechterhalten. Wie lautet die moderne Definition des Elementbegriffs? 1 20080213-130914Test_2_Elektronenkonfiguration[1].doc; 13.02.2008 Schulzentrum Längenstein, ste Chemie GU 9 Lernzielkontrolle 25 17. Warum unterscheiden sich die Ionisierungsenergien für die beiden Elektronen des Helium-Atoms, obwohl sie zur selben Energiestufe gehören? 1 18. Warum nehmen die Atomradien innerhalb einer Periode von links nach rechts ab, obschon mehr Elementarteilchen (Elektronen, Protonen und Neutronen) hinzukommen? 1 19. Warum ist der Durchmesser von negativen Chlor-Ionen aber wesentlich grösser als von den positiven Natrium-Ionen? 1 20. Erkläre mit Hilfe von Natrium und Chlor, wie eine Ionenverbindung entsteht? 2 20080213-130914Test_2_Elektronenkonfiguration[1].doc; 13.02.2008 Schulzentrum Längenstein, ste Chemie GU 9 20080213-130914Test_2_Elektronenkonfiguration[1].doc; 13.02.2008 Lernzielkontrolle Schulzentrum Längenstein, ste