Arbeitsblatt: Säure Definition - Sicherheit
Material-Details
Gefahrensymbole von Säuren, Säure Definition, Säuren kennenlernen
Chemie
Säuren / Basen
9. Schuljahr
2 Seiten
Statistik
199089
1148
5
20.09.2021
Autor/in
Arne Funke
Land: Deutschland
Registriert vor 2006
Textauszüge aus dem Inhalt:
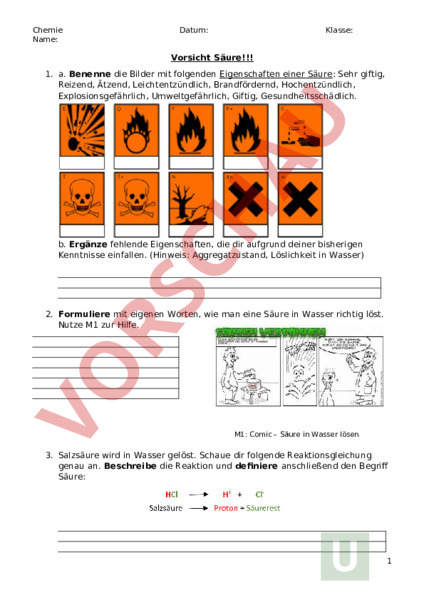
Chemie Name: Datum: Klasse: Vorsicht Säure!!! 1. a. Benenne die Bilder mit folgenden Eigenschaften einer Säure: Sehr giftig, Reizend, Ätzend, Leichtentzündlich, Brandfördernd, Hochentzündlich, Explosionsgefährlich, Umweltgefährlich, Giftig, Gesundheitsschädlich. b. Ergänze fehlende Eigenschaften, die dir aufgrund deiner bisherigen Kenntnisse einfallen. (Hinweis: Aggregatzustand, Löslichkeit in Wasser) 2. Formuliere mit eigenen Worten, wie man eine Säure in Wasser richtig löst. Nutze M1 zur Hilfe. M1: Comic – Säure in Wasser lösen 3. Salzsäure wird in Wasser gelöst. Schaue dir folgende Reaktionsgleichung genau an. Beschreibe die Reaktion und definiere anschließend den Begriff Säure: 1 4. a) Beschrifte die Abbildung mit folgenden Begriffen: Anion, Proton, Kation, Cl-. H (.) (Chorid-Ion) b) Ergänze folgenden Lückentext. Ionen sind Teilchen, die eine Ladung tragen. Ionen die eine positive Ladung tragen heißen Ionen die eine negative Ladung tragen heißen Bei der Dissoziation . von Chlorwasserstoff () in Wasser, spaltet sich ein Proton (.) ab. Das Proton ist das . Der verbleibende Säurerest ist das . 5. Ergänze die folgende Tabelle: Name Salzsäure Schwefelsäur Formel HCl H2SO4 Salpetersäure Phosphorsäur HNO3 H3PO4 Essigsäure CH3COOH Aus welchen Atomen besteht die Säure? 1 Wasserstoffatom, 1 Chloratom 6. Suche dir zwei Säuren aus Aufgabe 5 und schreibe jeweils drei für dich wichtige Informationen heraus. Säure 1: 2 Säure 2: 7. Infotext: Vergleicht man die Reaktion von Essigsäure und Salzsäure mit Zink, erkennt man, dass die Salzsäure viel heftiger reagiert, trotz gleicher Konzentration. Doch woran liegt das? Die Stärke einer Säure hängt von einem Bestandteil der Säure ab, dem Wasserstoff-Ion, und dem Verhalten der Säure in Lösung. Bei einer großen Menge HClMoleküle spalten sich fast alle auf. Sie dissoziiert stark. Bei der Essigsäure spalten sich dagegen nur wenige Moleküle auf und so liegen weniger H-Ionen in der Lösung vor. Sie dissoziiert schwach. Die Säuren teilt man in schwach oder stark ein, je nachdem wie viele Moleküle der Säure dissoziieren. Je mehr Moleküle dissoziieren (sich aufspalten), desto stärker reagiert die Säure. Die Konzentration gibt an, wie viel Gramm der Säure in 100 ml wässriger Lösung gelöst sind. Bei einer 5%-igen Säure sind 5g der Säure in 100 der Säurelösung gelöst. Vergleicht man verschiedene Konzentrationen einer einzigen Säure mit einander (z.B. 5%-ige Salzsäure mit 75%-iger Salzsäure), so reagiert diejenige mit höherer Konzentration heftiger. a) Erläutere, wann eine Säure stark oder schwach ist. b) Beschreibe mit eigenen Worten, was man unter der Konzentration einer Säure versteht. c) Auf dem Etikett einer Säure steht: 36%ige Salzsäure. Erkläre die Bedeutung. 7. Infotext: Vergleicht man die Reaktion von Essigsäure und Salzsäure mit Zink, erkennt man, dass die Salzsäure viel heftiger reagiert, trotz gleicher Konzentration. Doch woran liegt das? Die Stärke einer Säure hängt von einem Bestandteil der Säure ab, dem Wasserstoff-Ion, und dem Verhalten der Säure in Lösung. Bei einer großen Menge HClMoleküle spalten sich fast alle auf. Sie dissoziiert stark. Bei der Essigsäure spalten sich dagegen nur wenige Moleküle auf und so liegen weniger H-Ionen in der Lösung vor. Sie dissoziiert schwach. Die Säuren teilt man in schwach oder stark ein, je nachdem wie viele Moleküle der Säure dissoziieren. Je mehr Moleküle dissoziieren (sich aufspalten), desto stärker reagiert die Säure. Die Konzentration gibt an, wie viel Gramm der Säure in 100 ml wässriger Lösung gelöst sind. Bei einer 5%-igen Säure sind 5g der Säure in 100 der Säurelösung gelöst. Vergleicht man verschiedene Konzentrationen einer einzigen Säure mit einander (z.B. 5%-ige Salzsäure mit 75%-iger Salzsäure), so reagiert diejenige mit höherer Konzentration heftiger. a) Erläutere, wann eine Säure stark oder schwach ist. 3 b) Beschreibe mit eigenen Worten, was man unter der Konzentration einer Säure versteht. c) Auf dem Etikett einer Säure steht: 36%ige Salzsäure. Erkläre die Bedeutung. 4