Arbeitsblatt: Test Aufbau der Materie
Material-Details
Test zu Aggregatzuständen und Atommodellen von Dalton und Rutherford. Zudem Periodensystem der Elemente. Derzeit noch ohne Lösungen.
Chemie
Atome
8. Schuljahr
5 Seiten
Statistik
32768
2888
58
16.01.2009
Autor/in
iMike (Spitzname)
Bubenbergstrasse 15
3700 Spiez
3700 Spiez
079 356 09 18
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
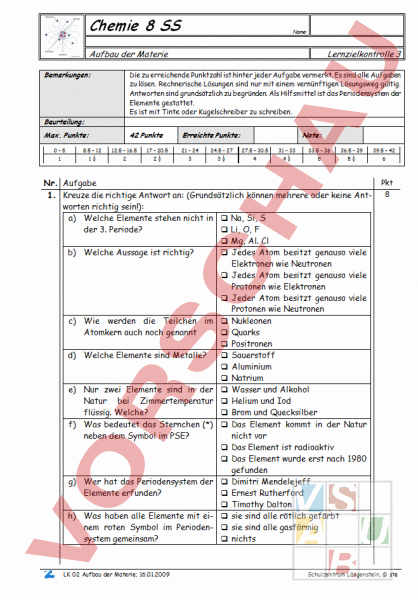
Chemie 8 SS Name: Aufbau der Materie Bemerkungen: Lernzielkontrolle 3 Die zu erreichende Punktzahl ist hinter jeder Aufgabe vermerkt. Es sind alle Aufgaben zu lösen. Rechnerische Lösungen sind nur mit einem vernünftigen Lösungsweg gültig. Antworten sind grundsätzlich zu begründen. Als Hilfsmittel ist das Periodensystem der Elemente gestattet. Es ist mit Tinte oder Kugelschreiber zu schreiben. Beurteilung: Max. Punkte: 42 Punkte Erreichte Punkte: Note: 0–8 8.5 – 12 12.5 – 16.5 17 – 20.5 21 – 24 24.5 – 27 27.5 – 30.5 31 – 33 33.5 – 36 36.5 – 39 39.5 – 42 1 1 2 2 3 3 4 4 5 5 6 Nr. Aufgabe 1. Kreuze die richtige Antwort an: (Grundsätzlich können mehrere oder keine Antworten richtig sein!): a) Welche Elemente stehen nicht in Na, Si, der 3. Periode? Li, O, Mg, Al. Cl b) Welche Aussage ist richtig? Jedes Atom besitzt genauso viele Elektronen wie Neutronen Jedes Atom besitzt genauso viele Protonen wie Elektronen Jeder Atom besitzt genauso viele Protonen wie Neutronen c) Wie werden die Teilchen im Nukleonen Atomkern auch noch genannt Quarks Positronen d) Welche Elemente sind Metalle? Sauerstoff Aluminium Natrium e) Nur zwei Elemente sind in der Wasser und Alkohol Natur bei Zimmertemperatur Helium und Iod flüssig. Welche? Brom und Quecksilber f) Was bedeutet das Sternchen (*) Das Element kommt in der Natur neben dem Symbol im PSE? nicht vor Das Element ist radioaktiv Das Element wurde erst nach 1980 gefunden g) Wer hat das Periodensystem der Dimitri Mendelejeff Elemente erfunden? Ernest Rutherford Timothy Dalton h) Was haben alle Elemente mit ei- sie sind alle rötlich gefärbt nem roten Symbol im Perioden- sie sind alle gasförmig system gemeinsam? nichts 20090115-191014LK_02_Aufbau_der_Materie[1].doc; 16.01.2009 Pkt 8 Schulzentrum Längenstein, ste Chemie GU 9 i) Was ist ein „Ion? j) Welche Aussage(n) ist/sind richtig? k) Wie heisst der Übergang von gasförmig zu flüssig? l) Welcher Übergang wird „sublimieren genannt? m) Mit Kernladungszahl wird die Grösse der Ladung im Atomkern bezeichnet. Welcher Grösse entspricht die Kernladungszahl? Wie gross misst der Durchmesser eines Atoms ca.? n) o) Was sind „Isotope? p) Was könnte die folgende Abbildung zeigen? Lernzielkontrolle Ein Atom mit gleichvielen Protonen wie Elektronen Ein Atom mit mehr Elektronen als Protonen Ein Atom mit weniger Elektronen als Protonen Die Masse der Atomhülle ist ca. 100 mal kleiner als die des Atoms Der Atomkern vereint ca. 99.9% der ganzen Masse des Atoms Ein Neutron und ein Proton haben ungefähr die gleiche Masse verdampfen sublimieren resublimieren kondensieren fest flüssig gasförmig fest fest gasförmig flüssig fest Anzahl Protonen Anzahl Neutronen Anzahl Elektronen Ordnungszahl 1/1000 mm 1/100�00 mm 1/1�00�00 mm Atome mit gleicher Massenzahl aber unterschiedlicher Ladungszahl Atome gleicher Ordnungszahl aber unterschiedlicher Massenzahl Atome, die sehr leicht den menschl. Körper durchdringen, also z.B. radioaktiv sind. Teilchenmodell von Quecksilber Teilchenmodell von Gold Teilchenmodell von Sauerstoff Teilchenmodell von Eisen Teilchenmodell von Wasser 20090115-191014LK_02_Aufbau_der_Materie[1].doc; 16.01.2009 8 Schulzentrum Längenstein, ste Chemie GU 9 Lernzielkontrolle 2. Welche Informationen entnimmst du direkt den folgenden Angaben: 12 Anzahl Protonen: 14 Anzahl Elektronen: Anzahl Neutronen: Name des Elementes: Massenzahl: Anzahl Protonen: 65 Anzahl Elektronen: Zn Anzahl Neutronen: Name des Elementes: Massenzahl: Anzahl Protonen: Anzahl Elektronen: 238 Anzahl Neutronen: Name des Elementes: Massenzahl: Anzahl Protonen: 35 Cl Anzahl Elektronen: Anzahl Neutronen: Name des Elementes: Massenzahl: Anzahl Protonen: 28 Al 2 Anzahl Elektronen: Anzahl Neutronen: Name des Elementes: Massenzahl: Anzahl Protonen: 45 Sc 3 Anzahl Elektronen: Anzahl Neutronen: Name des Elementes: Massenzahl: 20090115-191014LK_02_Aufbau_der_Materie[1].doc; 16.01.2009 Schulzentrum Längenstein, ste Chemie GU 9 Lernzielkontrolle 3. Worin unterscheiden sich die beiden Atommodelle von Dalton und Rutherford? 2 4. Lies die folgenden Informationen aus dem Periodensystem der Elemente heraus für das Element „Platin: 3 Name: Platin Symbol: Ordnungszahl: Anzahl Elektronen: Anzahl Neutronen: Massenzahl: Schmelzpunkt: Siedepunkt: Dichte: Elektronnegativität: 5. Bei einer Sorte radioaktiver Strahlung handelt es sich um 2-fach positiv geladener Teilchen mit der Masse 4u. Um welche Atomkerne handelt es sich? Zeichne und beschrifte einen solchen Atomkern 2 6. Die Massenzahl von Sauerstoff wird mit genau 16 angegeben. Bei Tellur beträgt sich hingegen 127.60. Warum ist die Massenzahl bei Tellur nicht ganzzahlig? 2 20090115-191014LK_02_Aufbau_der_Materie[1].doc; 16.01.2009 Schulzentrum Längenstein, ste Chemie GU 9 Lernzielkontrolle 7. Zeichne mit Hilfe des Teilchenmodells den Aggregatzustand von „Gallium bei Zimmertemperatur (22C). 2 8. Erläutere und erkläre die folgende Darstellung. Worum handelt es sich, wieso sieht sie so aus? 3 20090115-191014LK_02_Aufbau_der_Materie[1].doc; 16.01.2009 Schulzentrum Längenstein, ste