Arbeitsblatt: Chemische Elemente
Material-Details
Beschreibung einiger Elemente
Chemie
Elemente / Periodensystem
7. Schuljahr
6 Seiten
Statistik
4426
2512
20
12.02.2007
Autor/in
Monika Müller
Land: Schweiz
Registriert vor 2006
Textauszüge aus dem Inhalt:
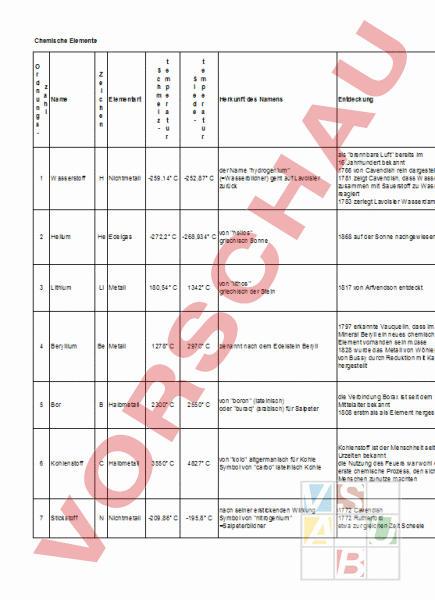
Chemische Elemente r n n s 1 2 3 a Name l Wasserstoff Helium Lithium e c Elementart e Nichtmetall He Edelgas Li Metall c m l - e p r t r i d - e p r t r Herkunft des Namens Entdeckung Eigenschaften Vorkommen Verwendung als brennbare Luft bereits im 16.Jahrhundert bekannt 1766 von Cavendish rein dargestellt 1781 zeigt Cavendish, dass Wasserstoff zusammen mit Sauerstoff zu Wasser reagiert 1783 zerlegt Lavoisier Wasserdampf farb-, geschmack- und geruchloses Gas das Gas mit der geringsten Dichte zeigt unter extrem hohem Druck metallische Eigenschaften brennbar im Gemisch mit Sauerstoff oder Chlor explosiv häufigstes Element im Weltall in Wasser, Erdöl und Erdgas zur Fetthärtung zum Schweissen Raketentreibstoff Kraftfahrzeugantrieb 1868 auf der Sonne nachgewiesen farb-, geruch- und geschmackloses Gas nur atomar vorkommend, geht keine Verbindung ein Helium ist das am schwersten zu verflüssigende Gas nach Wasserstoff das häufigste Element im Weltall die Sonne besteht zu 15% aus Helium und 84% aus Wasserstoff auf der Erde nur in der Luft und in manchen Erdgasen und in radioaktiven Mineralen Ballongas aufgrund seiner geringen Dichte für Kühlzwecke Füllgas für Leuchtröhren für Taucherluft von lithos griechisch der Stein 1817 von Arfvendson entdeckt an frischen Schnittflächen silberweisses Alkalimetall das Metall mit der geringsten Dichte Aufbewahrung in Benzin reagiert mit Wasser Flammenfärbung: intensiv karminrot in Spodumen in Batterien in Legierungen für die Raumfahrt und in Legierungen für Achslager in Laborgas graues, sehr hartes Leichtmetall bei normaler Temperatur spröde leicht oxidierbar löslich in verdünnten Säuren und Laugen im Beryll chemisches Verhalten ähnelt dem Aluminium Beryllium und seine Verbindungen sind giftig der Name hydrogenium -259,14 -252,87 (Wasserbildner) geht auf Lavoisier zurück von helios -272,2 -268,934 griechisch Sonne 180,54 1342 4 Beryllium Be Metall 1278 2970 benannt nach dem Edelstein Beryll 1797 erkannte Vauquelin, dass im Mineral Beryll ein neues chemisches Element vorhanden sein müsse 1828 wurde das Metall von Wöhler sowie von Bussy durch Reduktion mit Kalium hergestellt 5 Bor Halbmetall 2300 2550 von boron (lateinisch) oder buraq (arabisch) für Salpeter schwärzlich-graues Halbmetall die Verbindung Borax ist seit dem frühen kristallines Bor ist nach Diamant das Mittelalter bekannt härteste aller Elemente 1808 erstmals als Element hergestellt nicht sehr reaktionsfreudig reagiert aber bei höheren Temperaturen von kolo altgermanisch für Kohle Symbol von carbo lateinisch Kohle nach seiner erstickenden Wirkung Symbol von nitrogenium Salpeterbildner 6 Kohlenstoff Halbmetall 3550 4827 7 Stickstoff Nichtmetall -209,86 -195,8 Legierungsbestandteil von funkenfreien Legierungen in Uhrfedern Kerntechnik Fenster für Röntgenröhren nur gebunden in Boracit, Borax, Kernit Ferrobor als Legierungszusatz in der Stahlindustrie Kohlenstoff ist der Menschheit seit Urzeiten bekannt die Nutzung des Feuers war wohl der erste chemische Prozess, den sich die Menschen zunutze machten bei gewöhnlicher Temperatur reaktionsträge mit Metallen und Nichtmetallen bildet Kohlenstoff beim Erhitzen Carbide C-Atome können sich im Gegensatz zu anderen Elementen durch Einfach-, Doppel- oder Dreifachbindungen mit anderen C-Atomen zu Ketten oder Ringen verbinden in Carbonaten CO2 in der Luft in allen Lebewesen in Kohle, Erdöl und Erdgas Diamant für Schmuck, Bohrer, Achslager Graphit als Schmiermittel, in Bleistiften Kohle als Reduktionsmittel bei der Metallgewinnung als Füllstoff in Reifengummi, Schuhcreme, Tusche 1772 Cavendish 1772 Rutherford etwa zur gleichen Zeit Scheele farb-, geruch- und geschmackloses Gas unbrennbar sehr reaktionsträge sehr stabile Moleküle Hauptbestandteil der Luft in Salpeter in Lebewesen in Kohle flüssiger Stickstoff als Kühlmittel Schutzgas beim Umgang mit feuergefährlichen Stoffen 8 9 Sauerstoff Fluor 10 Neon 11 Natrium 12 Magnesium 13 Aluminium 14 Silicium Nichtmetall Nichtmetall Ne Edelgas Na Metall Mg Metall Al Metall Si Halbmetall 1772 erhält Scheele durch Zersetzung von Quecksilberoxid Feuerluft, teilt dies aber erst 1777 mit 1774 erhält Priestley durch Zersetzung von Quecksilberoxid mit Hilfe eines Brennglases ebenfalls Sauerstoff farb-, geruch- und geschmackloses Gas in flüssiger und fester Form hellblau wenn sich ein Stoff mit Sauerstoff verbindet, spricht man von einer Oxidation Verbindungen mit Sauerstoff heissen Oxide -219,61 -187,52 von fluere lateinisch fliessen Flusssäure bereits im 16.Jahrhundert bekannt erst 1886 gelang es Moissan, elementares Fluor durch Elektrolyse herzustellen schwach gelblich-grünes Gas mit chlorähnlichem Geruch reaktionsfähigstes Nichtmetall (reagiert mit fast allen anderen chemischen Elementen, auch einigen Edelgasen) nur in Verbindungen explosionsartige Reaktion mit Minerale: Fluorit (Flussspat), Kryolith, Wasserstoff Fluorapatit Magnesium und Kupfer bilden mit Fluor dichte Fluoridüberzüge, sie sind daher als Baustoffe für Apparaturen zum Umgang mit Fluor geeignet -248,67 1898 wenige Tage nach der Entdeckung von Krypton farb-, geruch- und geschmackloses Gas nur atomar vorkommend, geht keine Verbindung ein von neter hebräisch Soda 1807 von Davy entdeckt weiches, leicht schneidbares, an frischen Schnittflächen silbrig glänzendes Alkalimetall läuft an der Luft sofort an sehr reaktionsfähig, daher Aufbewahrung in Silicaten in Petroleum oder Paraffinöl als Natriumchlorid im Meerwasser heftige Reaktion mit Wasser Salze des Natriums sind meist farblos und wasserlöslich Flammenfärbung: orange-gelb flüssiges Natrium als Kühlmittel in Flugzeugmotoren und Kernreaktoren im Labor zur Trocknung von wasserhaltigen Lösungsmitteln zur Darstellung schwer reduzierbarer Metalle von Magnesia (Stadt in Kleinasien) 1808 gewann Davy eine kleine Menge unreines Magnesium 1829 wurde das Metall in reiner Form durch Bussy erhalten silberglänzendes, weiches Leichtmetall verbrennt an der Luft mit hellweisser in Silicaten und Salzen Flamme im Meerwasser wird leicht, auch von schwachen Säuren, im Blattgrün gelöst Legierungsbestandteil von Leichtmetalllegierungen (z.B. Elektronmetall für Flugzeugbau und Rennräder) Reduktionsmittel Magnesiumsalze als Pflanzennährstoffe 1825 gewann ein dänischer Chemiker stark verunreinigtes Aluminium 1827 konnte Friedrich Wöhler erstmals reines pulverförmiges Aluminium herstellen silberglänzendes, weiches, dehnbares Leichtmetall guter elektrischer Leiter und Wärmeleiter keine Flammenfärbung dritthäufigstes Element unedles Metall, das aber durch eine sich häufigstes Metall der Erdkruste mit Sauerstoff sofort bildende, dichte und widerstandsfähige Oxidschicht geschützt wird löslich in verdünnten Säuren und Laugen Metallbau Hochspannungsleitungen Folien Feuerwerk Legierungen für Raketen-, Flugzeug- und Automobilbau Siliciumdioxid schon lange bekannt erst 1823 konnte reines Silicium hergestellt werden metallisch glänzendes, dunkelgraues, hartes und sprödes Übergangselement leitet den elektrischen Strom in Säuren unlöslich zweithäufigstes Element der Erdkruste in Laugen bei Erwärmen löslich reagiert bei Erhitzen mit Stickstoff, Chlor, Brom, Iod und Metallen, mit Fluor auch bei Zimmertemperatur Herstellung von Silicon Ferrosilicium zur Stahlherstellung hochrein für elektronische Bauteile und Solarzellen Quarz zur Glasherstellung Zement Porzellan Steingut und Glas sind Verbindungen des Siliciums -218,4 97,81 648,8 660,37 1410 Namensgebung oxygenium (Säurebildner) von Lavoisier, -182,96 der irrtümlich annahm, dass dieses Gas für die Säurebildung verantwortlich sei -245,9 882,9 1107 2467 2355 von to neon griechisch das Neue von alumen lateinisch Alaun von silex lateinisch Kieselstein in der Luft gebunden in der Erdkruste Ozon in der Stratosphäre zum Schweissen und Schneiden von Metallen in Atemgeräten zur Stahlerzeugung nach dem SauerstoffAufblasverfahren zum Raketenantrieb zur Herstellung fluororganischer Verbindungen (Teflon) Fluorverbindungen in Zahnpasta (Vorbeugung gegen Karies) Füllgas für Leuchtstoffröhren (rote Leuchtreklame) im Weltall eines der häufigsten Elemente in Gas-Lasern und Fernsehröhren auf der Erde nur in der Luft in Glimmlampen flüssiges Neon in der Kältetechnik 15 Phosphor 16 Schwefel Halbmetall Nichtmetall 44,1 112,8 280 von phosphoros griechisch Lichtträger 1669 vom Alchimisten Henning Brand bei starkem Glühen von eingedampftem Harn entdeckt, war jedoch vielleicht schon früher bekannt lateinisch sulfur das deutsche Wort geht zurück auf 444,67 von alters her bekannt swep (für schlafen, vielleicht wegen der Giftigkeit des Schwefeldioxids) 17 Chlor Cl Nichtmetall -100,98 -34,06 von chloros griechisch gelbgrün Natriumchlorid und Salmiak schon sehr lange bekannt Salzsäure wird erstmals 1595 von Libavius erwähnt Scheele entdeckte 1774 freies Chlor 18 Argon Ar Edelgas -189,2 -185,7 von argos griechisch das Träge 1894 durch Ramsay und Rayleigh 19 Kalium 20 Calcium Metall Ca Metall 63,65 839 774 1484 von al kalja arabisch Pflanzenasche von calx lateinisch Kalkstein 1807 von Davy entdeckt 1808 wurde von Davy erstmals metallisches Calcium hergestellt Übergangselement mit 3 Modifikationen: weiss (nichtmetallisch, sehr giftig), rot (nichtmetallisch, ungiftig), schwarz in der Natur in Phosphaten (metallisch, ungiftig) sowie in Lebewesen in Form von weisser Phosphor entflammt von selbst Phosphorsäurestern an der Luft (Aufbewahrung unter Wasser) das Leuchten im Dunkeln beruht auf langsamer Oxidation bei gewöhlicher Temperatur gelbe Kristalle geruch- und geschmacklos unlöslich in Wasser löslich in Kohlenstoffsulfid verbrennt mit blauer Flamme reagiert bei höherer Temperatur mit Metallen zu Sulfiden, mit Wasserstoff zu Schwefelwasserstoff (Geruch von faulen Eiern) gelblich-grünes Gas von stechendem Geruch nicht brennbar sehr reaktionsfähig am heftigsten mit Alkalimetallen verdrängt Brom und Iod aus ihren Wasserstoff- und Metallverbindungen Gemische aus Chlor und Wasserstoff sind explosiv bleichende Wirkung auf viele Farbstoffe ätzt die Schleimhäute zerstört Lungengewebe farb-, geruch- und geschmackloses Gas nur atomar vorkommend geht keine Verbindungen ein wachsfreies, sehr leicht schneibares Alkalimetall der metallische Glanz an frischen Schnittflächen verschwindet infolge Oxidation sofort sehr reaktionsfreudig die Aufbewahrung erfolgt in Petroleum oder Paraffinöl heftige Reaktion mit Wasser Flammenfärbung: hellviolett silberweisses Metall, das an der Luft schnell dunkel anläuft reagiert bei Erhitzen lebhaft mit Sauerstoff und den Halogenen bei Erhitzen an der Luft auch mit Stickstoff Flammenfärbung: ziegelrot Herstellung von Phosphorsäure und Phosphaten (Wasch- und Düngemittel) roter Phosphor in Zündholzreibflächen weisser Phosphor wird militärisch als Brandmittel genützt gebunden als Sulfid und als Sulfat in Kohle und Erdöl in Lebewesen (besonders in Haaren, Federn, Haut) elementar in vulkanischen Gesteinen Produktion von Schwefelsäure in Zünhölzern Farben Medikamenten nur gebunden in Salzen wichtige Grundchemikalie der chemischen Industrie Bleichmittel bei der Papierherstellung zur Produktion von Kunststoffen zur Entkeimung von Trinkwasser und Wasser in Badeanstalten in der Luft Füllung von Glühlampen und Leuchtröhren in Lasern und Geigerzählern Schutzgas bei Elektroschweissungen nur in Verbindungen in Salzlagerstätten als Chlorid oder Sulfat in Meerwasser Gesteinen Erdboden in Pflanzenasche Kaliumsalze finden als Düngemittel Verwendung Kaliumcarbonat zur Glasherstellung Kaliumlauge zur Seifenproduktion fünfthäufigstes Element der Erdkruste dritthäufigstes Metall in der Natur als Carbonat, Sulfat, Silicat, Phosphat und Fluorid Knochen und Zähne enthalten Calciumphosphat Reduktionsmittel bei der Herstellung von Uran, Vanadium und Thorium Legierungszusatz zum Härten von Blei zur Trocknung von Alkoholen Ca-Verbindungen im Bauwesen sowie als Düngemittel 22 Titan 24 Chrom 25 Mangan 26 Eisen 29 Kupfer Ti Metall Cr Metall Mn Metall Fe Metall Cu Metall 1660 1875 1244 1539 1083,4 3287 2671 2032 3070 2595 1791 vermutete Gregor in einem schwarzen Sand aus dem Menachine-Tal in Cornwall (Menakanit) ein neues Metall Klaproth fand in Rutil das Oxid eines noch unbekannten Metalles, das er Titan nannte, und konnte zeigen, dass das Metall aus dem Menakanit mit dem aus dem Rutil identisch ist reines Titan wurde erstmals 1895 von Moisan elektrolytisch hergestellt stahlähnlich aussehendes, gut schmiedbares Leichtmetall guter elektrischer Leiter bei gewöhnlicher Temperatur an der Luft und gegen feuchtes Chlor beständig bei höherer Temperatur Reaktion mit sehr verbreitet Sauerstoff und Stickstoff sowie den doch nur selten in grösseren Lagerstätten Halogenen fast jeder Ackerboden enthält Titan muss im Vakuum geschmolzen werden löslich in verdünnter Salz- und in Flussäure beständig gegenüber konzentrierter Salpetersäure Ti-Verbindungen sind meist violett in Legierungen mit Eisen, Aluminium, Molybdän und Mangan Bestandteil hochfester, leichter und hitzebeständiger Werkstoffe für den Schiffs- und Reaktorbau Reintitan in chemischen Anlagen in Knochennägeln von chroma griechisch Farbe (wegen der Vielfarbigkeit der Verbindungen) 1797 von Vanquelin im Krokoit (Rotbleierz) entdeckt silberglänzendes, hartes und zähes Metall behält seinen Glanz auch an feuchter Luft bei hoher Temperatur Reaktion mit Sauerstoff, Halogenen, Stickstoff, Phosphor, Bor und anderen Elementen löslich in Salzsäure Salpetersäure und Königswasser wirken in der Kälte nicht, beim Sieden nur schwache Reaktion lösliche Chromverbindungen sind giftig als Überzug auf Metallen mit Nickel als Zwischenschicht korrosionsbeständige Edelstähle Malerfarben in Ton- und Videobändern von magnesia nigra, einer schwarzen bei Magnesia in Kleinasien gefundenen Erde eisenfarbenes, hartes, sprödes Metall läuft an der Luft unter Bildung einer schützenden Deckschicht grau-bunt an 1774 von Gahn und Scheele in unreiner löst sich leicht in verdünnten Säuren Begleiter in Eisenerz Form erhalten und Magnesium genannt wird bereits von Wasser angegriffen Braunstein reines Mangan erstmals 1808 von John bildet zusammen mit Kupfer und Spurenelement in Pflanzen hergestellt Aluminium ferromagnetische Legierungen Farbe der Verbindnungen: rosa, grün, rotviolett als Legierungsbestandteil Mangan in Taschenlampenbatterien und als dunkelbraunes Farbpigment in Dachziegeln evtl. von isara keltisch stark, fest Symbol von lateinisch ferrum bläulichweisses, zähes, ziemlich weiches Metall erweicht bei Rotglut ferromagnetisch in trockener Luft und in sauerstoff- und Erzeugnisse aus Meteoriteneisen kohlendioxidfreiem Wasser wegen vierthäufigstes Element wurden in ca. 7000 Jahren alten dichter Oxidhaut beständig Eisenerze Grabstätten in Ägypten und Mesoptamien feuchte Luft oder kohlendioxidhaltiges im roten Blutfarbstoff gefunden Wasser greifen Eisen unter Rostbildung an Rost schützt das Grundmetall infolge Porösität nicht löslich in verdünnten Säuren wichtiges Gebrauchsmetall (Stahl) für Legierungen Weicheisenkerne für Transformatoren und Elektromagnete benannt nach den Titanen (Götter oder Riesen der griechischen Sage) lateinisch cuprum benannt nach der Insel Zypern Kupfer ist wahrscheinlich das erste Metall, das der Mensch zur Herstellung von Geräten benutzte rötlich, recht weiches und dehnbares Schwermetall guter Wärme- und Stromleiter oxidiert an feuchter Luft bildet mit CO2 und Wasser grünes Kupferhydroxidcarbonat unlöslich in Salzsäure löslich in Salpetersäure Kupferchlorid färbt die Flamme blaugrün im Chromit im Krokoit (Rotbleierz) meist in sulfidischen Erzen als Spurenelement im pflanzlichen und tierischen Organismus als Leiter in der Elektrotechnik für Heiz- und Kühlrohre Rohre für Gas- und Wasserinstallation Dachrinnen Kupfergefässe für Legierungen 30 Zink 36 Krypton 47 Silber 50 Zinn 53 Iod 54 Xenon Zn Metall Kr Edelgas Ag Metall Sn Metall Halbmetall Xe Edelgas 419,58 -156,6 961,93 231,97 113,6 -111,9 907 -152,3 2212 2270 benant nach der zinkigen (zackigen) Gestalt einiger seiner Erze von kryptos griechisch verborgen 1898 von Ramsay und Travers entdeckt farb-, geruch- und geschmackloses Gas nur atomar vorkommend geht unter normalen Bedingungen keine Verbindungen ein bildet bei tieferen Temperaturen Fluorverbindungen das Einatmen eines Krypton-SauerstoffGemisches führt zu tiefer Bewusstlosigkeit in der Luft weissglänzendes, weiches, sehr dehnbares Edelmetall hat von allen Metallen die beste Leitfähigkeit für Wärme und Elektrizität wird durch Schwefelwasserstoff von alters her bekannt wahrscheinlich von si-ra-pi-im assyrisch geschwärzt selten gediegen war bis etwa zur Mitte des weisses Metall wird nur von oxidierenden Säuren gelöst meist an Schwefel gebunden in 2.Jahrtausends vor Christus seltener und Symbol von lateinisch argentum Silberverbindungen sind meist farblos Begleitung von Blei- und Kupfererzen damit wertvoller als Gold und lichtempfindlich Silbernitrat ist gut wasserlöslich Silberchlorid dagegen wasserunlöslich Silbersalze bilden auf der Haut schwarze Flecken aus metallischem Silber von zein altgermanisch Stab oder Platte von alters her bekannt Symbol von lateinisch stannum von ioeides griechisch violett 185,24 ältere Schreibweise: Jod mit dem Symbol J -107,1 bläulich-weisses, nicht sehr hartes, unedles Metall löst sich in Säuren leicht auf Messing, eine Kupfer-Zink-Legierung, war löslich auch in Alkalilaugen schon im alten Griechenland bekannt, an der Luft bildet sich eine dichte Schicht Vorkommen in den wichtigsten Mineralien nicht jedoch das reine Zink aus Zinkhydroxidcarbonat, welche das Spurenelemente in tierischen und die Herstellung metallischen Zinks Metall schützt pflanzlichen Organismen begann um 1200 in Indien Zinkpulver reagiert lebhaft mit Schwefel zu Zinksulfid Zinksalze wirken giftig: saure Speisen nicht in Zinkgefässen aufbewahren! von to xenon griechisch das Fremde silberweiss glänzendes, weiches Schwermetall beständig gegenüber Luft, Wasser und schwachen Säuren löslich in starken Säuren in starken Laugen löst es sich beim Kochen in Kassiternit und Stannit zum Verzinken von Eisen und Stahl (Korrosionsschutz) als Konstruktionsmaterial in Taschenlampenbatterien als Reduktionsmittel für Zinklegierungen (Messing) Füllgas für Glühlampen in Leuchtröhren, Blitzbirnen und UVLasern Schmuck- und Münzmetall Silberamalgam für Zahnfüllungen für elektrische Kontakte als reflektierender Belag in Spiegeln Fotografie Weissblech Zinngeschirr Legierungen Orgelpfeifen 1811 von Courtois in Tangasche entdeckt dunkelgraue, fast blauschwarze, scharf riechende, metallisch glänzende Kristalle sublimiert bei langsamem Erhitzen zu violettem Dampf im Meerwasser bei raschem Erhitzen bildet sich im Schilddrüsenhormon schwarzes, flüssiges Iod löslich in Ethanol, Kohlenstoffsulfid und Chloroform, Benzol reaktionsträger als die anderen Halogene in der Pharmazie zur chemischen Analyse in der Fotografie in Halogenlampen Iodzusatz im Kochsalz 1898 von Ramsay und Travers entdeckt farb-, geruch- und geschmackloses Gas nur atomar vorkommend geht unter normalen Bedingungen keine Verbindungen ein es konnten jedoch Verbindungen mit Fluor und Sauerstoff hergestellt werden das Einatmen eines Xenon-SauerstoffGemisches führt zu tiefer Bewusstlosigkeit Füllgas für Leuchtröhren und Glühlampen Xenon-Hochdrucklampen Blitzlichtlampen Füllgas für Geigerzählrohre Narkose in der Luft und in Spuren in Erdgasen 78 Platin 79 Gold 80 Quecksilber Pt Metall Au Metall Hg Metall 1772 1063 -38,84 3827 von platina lateinisch kleines Silber wahrscheinlich bereits im Altertum bekannt erste Beschriebung von Scaliger 1557 ausführlichere Beschreibung 1748 von de Ulloa von gulth, gelo, gelva altgermanisch war wahrscheinlich das erste Metall, für gelb 2660,7 mit dem die frühen Menschen in Symbol von lateinisch aurum (aurora Berührung kamen Morgenröte) 356,58 flüssiges (lebendiges) Silber Symbol von griechisch hydrargyrum grauweisses, nicht sehr hartes, gut verformbares Schwermetall beim Erhitzen in sauerstoffhaltiger Umgebung überzieht sich Platin mit einer Oxidschicht, die das Metall vor weiterer Oxidation schützt gegenüber Säuren beständig gelbes, weiches Edelmetall das dehnbarste Metall an der Luft absolut beständig wird in Königswasser gelöst normale Säuren einschliesslich Salpetersäure greifen Gold nicht an meist elementar und legiert mit anderen Platinmetallen in Platinerzen oft in Flusssanden für chemische Geräte als Katalysator als Schmuck goldhaltiges Gestein Meerwasser für Schmuck und Münzen zum Vergolden für rotgefärbtes Goldrubinglas in der Zahntechnik für elektrische Kontakte gediegen (Tröpfchen im Gestein) oder als Cinnabarit für Thermometer Schaltkontakte für starke Ströme in Quecksilberdampflampen bei der Gewinnung von Natronlauge als Kathode bei der Gewinnung von Gold und Silber als Zahnamalgam bekannt seit mindestens 3500 Jahren bei Zimmertemperatur flüssiges, silberglänzendes, an der Luft beständiges, edles Metall vereinigt sich leich mit Halogenen und Schwefel bildet mit vielen anderen Metallen Legierungen gibt bereits bei Zimmertemperatur Dämpfe ab, die zu Vergiftungen führen können lösliche Verbindungen sind sehr giftig für Akkumulatoren als Antiklopfmittel im Benzin Legierungszusatz Schrotkugeln Munition Strahlenschutz Bedachungen als starke Strahlungs- und Ionisationsquelle in der Forschung im Gemisch mit Beryllium als Neutronenquelle 82 Blei Pb Metall 327,5 1740 griechisch molybos, lateinisch plumbum, altgermanisch blio bliw seit ca. 3000 vor Christus bekannt bläulich-weisses, sehr weiches Schwermetall an der Luft, in hartem Wasser und in Schwefelsäure sehr beständig im Galgenit (Bleiglanz) in weichem Wasser wird Blei angegriffen leicht löslich in Salpetersäure Blei und seine Verbindungen sind sehr giftig 84 Polonium Po Metall 254 962 benannt nach Polen (Heimatland von Marie Curie) 1898 von Marie und Pierre Curie als radioaktives Zerfallsprodukt des Urans entdeckt sprödes Metall giftig in sehr geringen Mengen im Uranerz 86 Radon Rn Edelgas -71 -61,8 von radius lateinisch der Strahl 1900 von Rutherford entdeckt radioaktives Edelgas farb-, geruch- und geschmackloses Gas nur atomar vorkommend geht unter normalen Bedingungen keine Verbindungen ein in der Atmosphäre entsteht als Zwischenprodukt des natürlichen Zerfalls von Radium 1789 von Klaproth in Pechblende entdeckt silberglänzendes, weiches, radioaktives Metall bei normaler Temperatur gegen Luft, Säuren und Laugen recht beständig löst sich in verdünnten Säuren bei Erwärmen zu Uran-Salzen Uranverbindungen sind zusätzlich zu der von ihnen ausgehenden Radioaktivität stark giftig, sie verursachen Nieren- und Leberschäden sowie innere Blutungen im Monazitsand Uranpechblende Carnotit 92 Uran Metall 1132,3 3818 benannt nach dem Planeten Uranus --- als Kernbrennstoff und zur KernwaffenProduktion für panzerbrechende Geschosse Uransalze wurden zur Färbung (gelb, orange, schwarz) von Glas und Keramik eingesetzt