Arbeitsblatt: katalysatoren
Material-Details
didaktische analyse
Chemie
Gemischte Themen
8. Schuljahr
1 Seiten
Statistik
80532
1109
0
29.04.2011
Autor/in
Irina Jäger
Land: Deutschland
Registriert vor 2006
Textauszüge aus dem Inhalt:
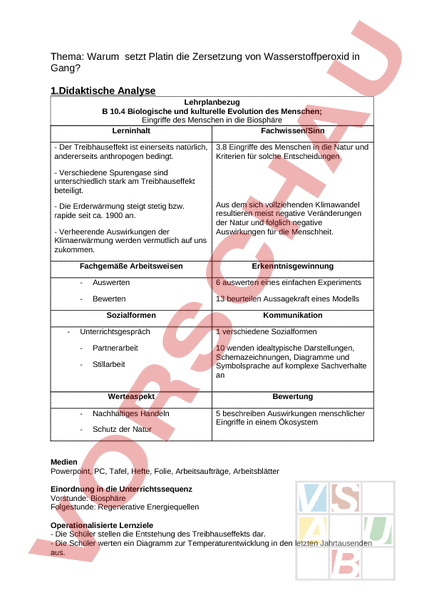
Thema: Warum setzt Platin die Zersetzung von Wasserstoffperoxid in Gang? 1.Didaktische Analyse Lehrplanbezug 10.4 Biologische und kulturelle Evolution des Menschen; Eingriffe des Menschen in die Biosphäre Lerninhalt Fachwissen/Sinn Der Treibhauseffekt ist einerseits natürlich, andererseits anthropogen bedingt. 3.8 Eingriffe des Menschen in die Natur und Kriterien für solche Entscheidungen Verschiedene Spurengase sind unterschiedlich stark am Treibhauseffekt beteiligt. Die Erderwärmung steigt stetig bzw. rapide seit ca. 1900 an. Verheerende Auswirkungen der Klimaerwärmung werden vermutlich auf uns zukommen. Fachgemäße Arbeitsweisen Erkenntnisgewinnung Auswerten 6 auswerten eines einfachen Experiments Bewerten 13 beurteilen Aussagekraft eines Modells Sozialformen Aus dem sich vollziehenden Klimawandel resultieren meist negative Veränderungen der Natur und folglich negative Auswirkungen für die Menschheit. Kommunikation Unterrichtsgespräch 1 verschiedene Sozialformen Partnerarbeit Stillarbeit 10 wenden idealtypische Darstellungen, Schemazeichnungen, Diagramme und Symbolsprache auf komplexe Sachverhalte an Werteaspekt Nachhaltiges Handeln Schutz der Natur Bewertung 5 beschreiben Auswirkungen menschlicher Eingriffe in einem Ökosystem Medien Powerpoint, PC, Tafel, Hefte, Folie, Arbeitsaufträge, Arbeitsblätter Einordnung in die Unterrichtssequenz Vorstunde: Biosphäre Folgestunde: Regenerative Energiequellen Operationalisierte Lernziele Die Schüler stellen die Entstehung des Treibhauseffekts dar. Die Schüler werten ein Diagramm zur Temperaturentwicklung in den letzten Jahrtausenden aus. Die Schüler stellen Auswirkungen des Klimawandels zusammenfassend dar. 4. Geplanter Stundenverlauf Methode/Medien Ergebnisse Problembegegnung 1.Stegreifaufgabe Wiederholung: L: Was ist die Aktivierungsenergie? L: Welche Reaktionen bezeichnet man als exotherm? L: Woher kommt diese frei werdende Energie? L: Welche Reaktionen bezeichnet man als endotherm? L: Wo verbleibt diese dauernd zugeführte Energie? L: Was wird bei der Erstellung eines Energiediagramms berücksichtigt? L: Warum sind Stoffe mit hohem Energiegehalt reaktionsträge? L: Wodurch ist eine chemische Reaktion gekennzeichnet? L: Zeichnet ein Reaktionsdiagramm 1. Motivation Ich zeige den Versuch „ Zersetzung von Wasserstoffperoxid L: Welche passiert, wenn ich Wasserstoffperoxid erhitze? S: Es bilden sich Bläschen. Glimmspannprobe ist positiv Ich lege ein Platinkugelchen L: Was ist die Beobachtung? 2. Problem: Kann man eine Reaktion beschleunigen? 3. Zielangabe Schüler sollen Wirkung von Katalysatoren auf die chemischen Reaktionen kennenlernen. Die Energie, die zugeführt wird, um die Reaktion in Gang zu setzen. Energie wird frei gesetzt. Energiereiche Ausgangstoffe reagieren zu energiearmen Reaktionsprodukten. Energie wird aufgenommen. Energiearme Ausgangsstoffe reagieren zu energiereichen Produkten. Stoffänderung, Energieumsatz Sie benötigen eine hohe Aktivierungsenergie. Durch Stoffänderung und einen Energieumsatz. Schüler zeichnen Reaktionsdiagramme für die folgenden Reaktionen: Magnesium Sauerstoff - Magnesiumoxid Energie Silberoxid Energie - Silber Sauerstoff Schülermeinungen Warum setzt Platin die Zersetzung von Wasserstoffperoxid in Gang? Problemlösung Teilziel 1: Was sind Katalysatoren? L: Welche Funktion hat Platin in dieser Reaktion? S: Es setzt die Reaktion in Gang. L: was passiert mit Platin während der Reaktion? S: passiert nichts. Diese Stoffe werden als Katalysatoren bezeichnet. Sie werden nicht verändert. Teilziel 2 Wie wirken Katalysatoren? Schüler vergleichen die Energiediagramme ohne Katalysator und mit Katalysator. L: Wie unterscheiden sich diese Diagramme von einander? S: Katalysator setzt die Aktivierungsenergie herab. L: Welchen Einfluss hat die Aktivierungsenergie auf den Ablauf einer chemischen Reaktion? S: Ihre Höhe entscheidet, wie leicht eine chemische Reaktion ablaufen kann. Teillösung (zu Teilziel 1 und 2): Unterrichtsgespräch, Film TA: Katalysatoren sind Stoffe, die chemische Reaktionen beschleunigen, ohne dabei verändert zu werden. B - AB K- AK AK B - AB K TA: Katalysatoren setzen die Aktivierungsenergie herab. Teilziel 3: Welche Bedeutung haben Katalysatoren? L: Wo werden Katalysatoren verwendet? S: Autoabgaskatalysatoren, Enzyme Teillösung: Unterrichtsgespräch Schlußzusammenfassung Problemanwendung: Bombardierkäfer Schüler beantworten die Fragen. Folie